针对检查发现的不符合要求问题,请相关省、自治区、直辖市药品监督管理局督促企业整改,要求企业评估产品安全风险,对存在安全风险的,按照《医疗器械召回管理办法》召回相关产品。企业完成整改后,相关省级药品监督管理局应及时组织对整改情况进行确认,并将确认结果报送国家药品监督管理局食品药品审核查验中心。
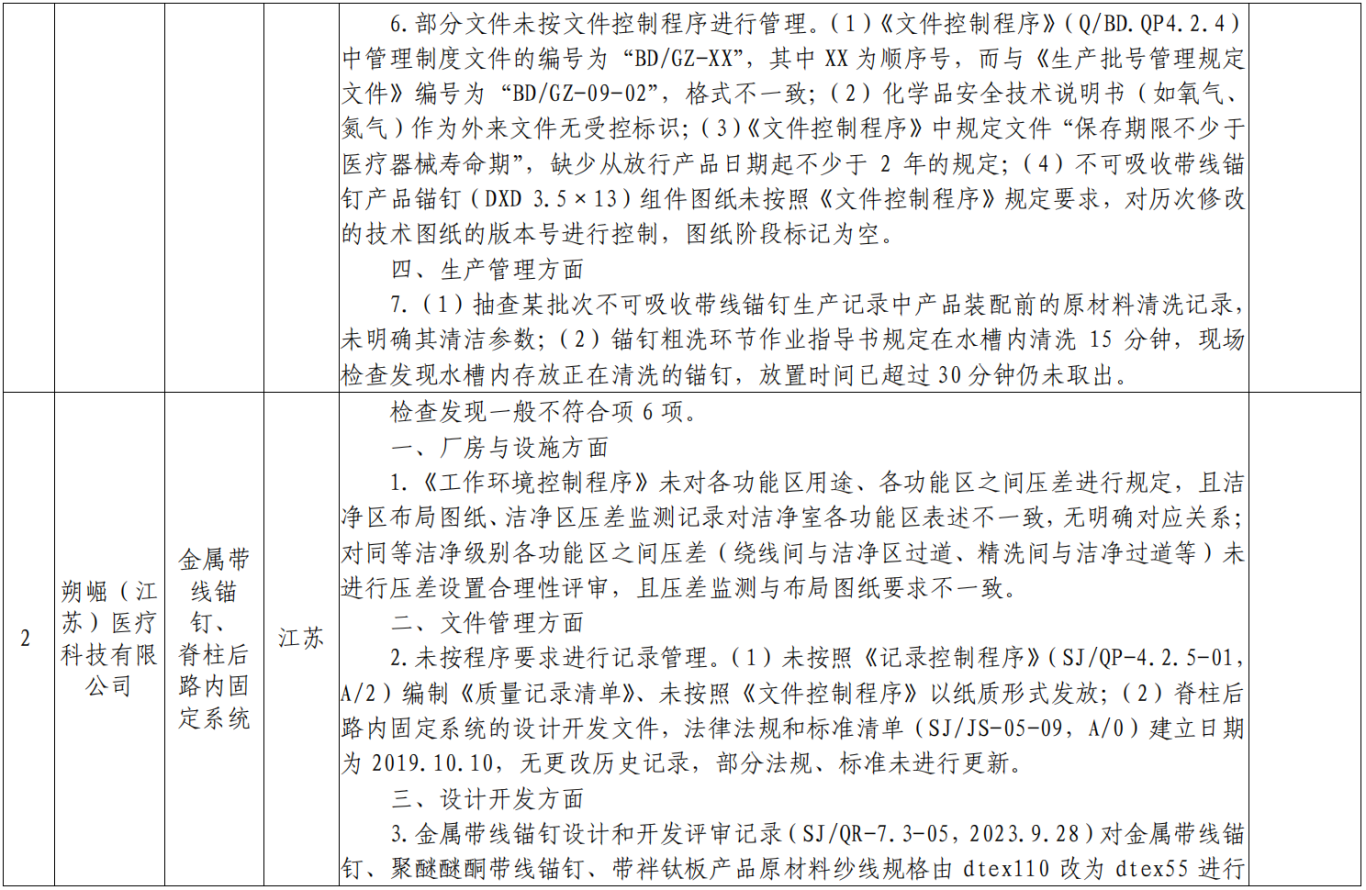
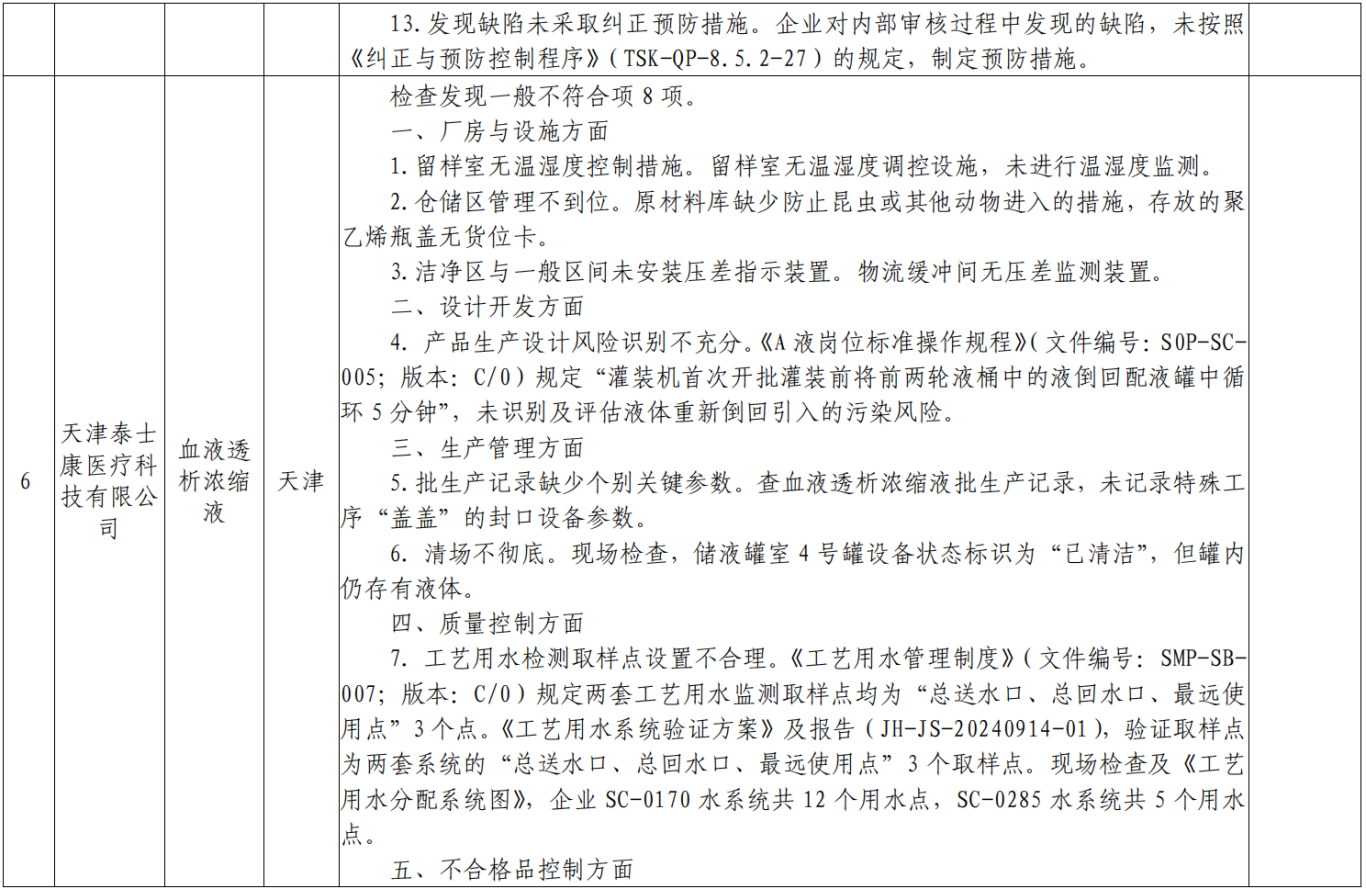
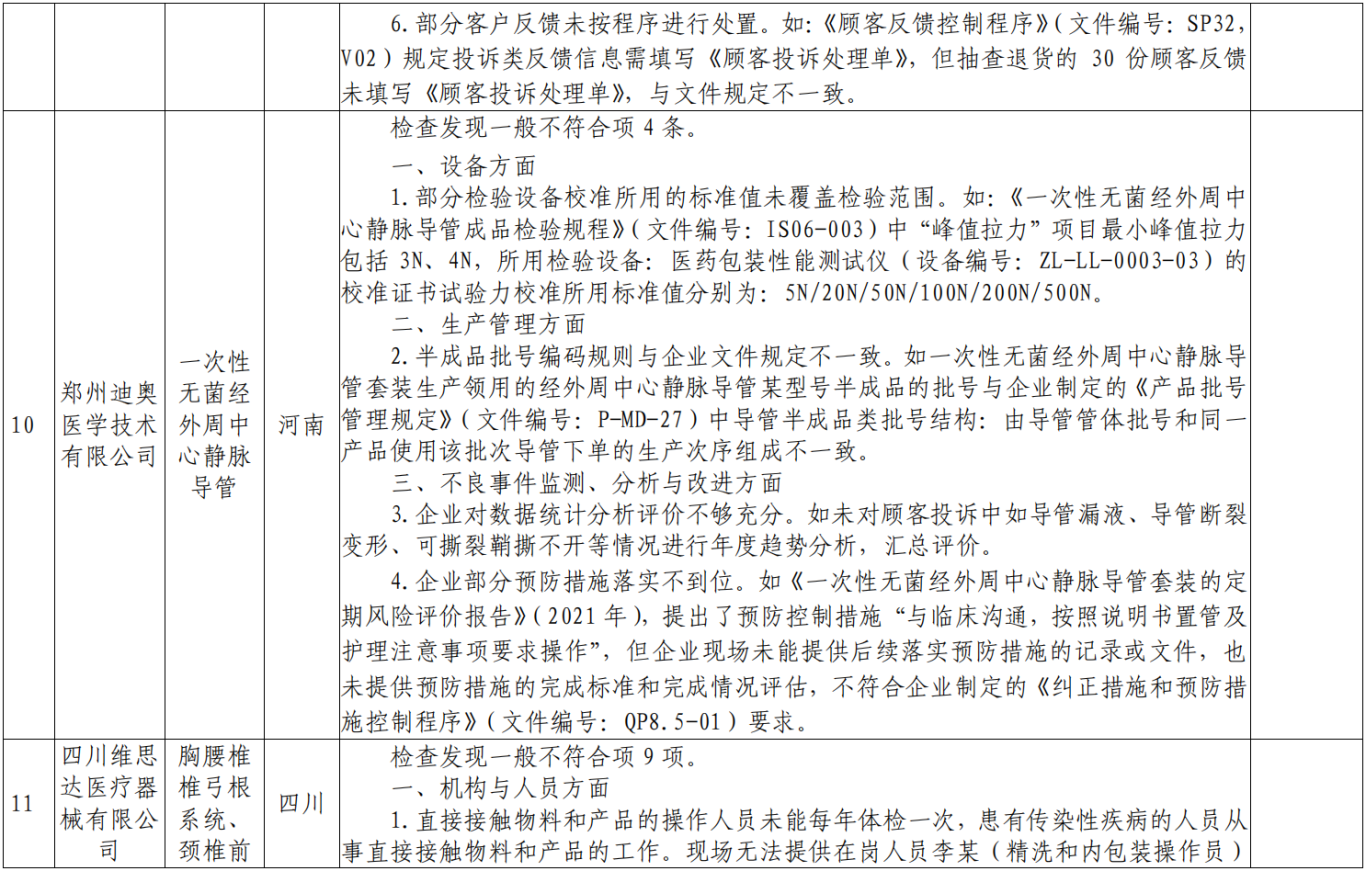
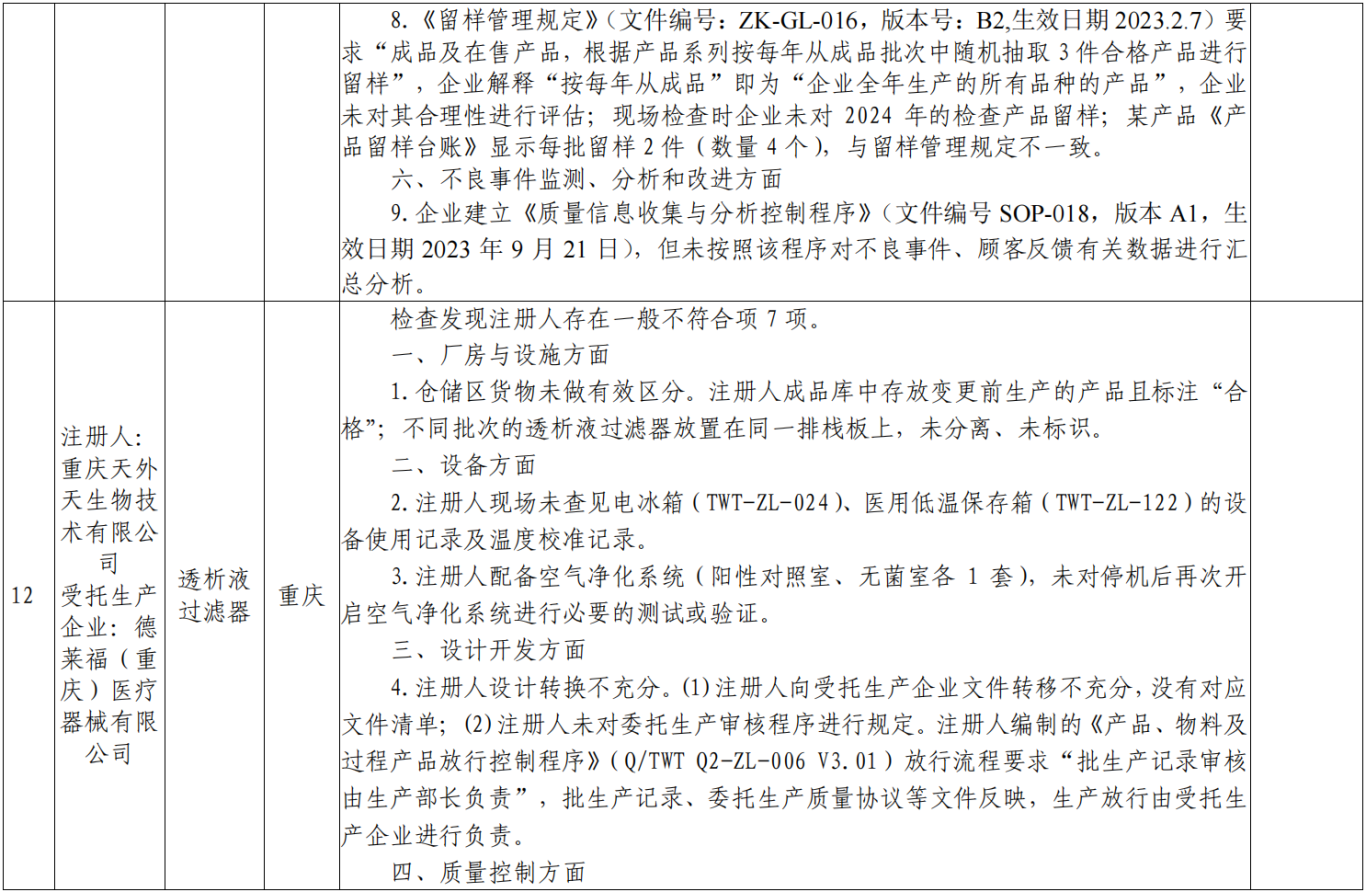
附表:核查中心2025年第一批医疗器械飞行检查情况汇总:



















针对检查发现的不符合要求问题,请相关省、自治区、直辖市药品监督管理局督促企业整改,要求企业评估产品安全风险,对存在安全风险的,按照《医疗器械召回管理办法》召回相关产品。企业完成整改后,相关省级药品监督管理局应及时组织对整改情况进行确认,并将确认结果报送国家药品监督管理局食品药品审核查验中心。
附表:核查中心2025年第一批医疗器械飞行检查情况汇总:






















