前言:2021年6月1日起,新修订的《医疗器械监督管理条例》已经正式实施,作为医疗器械监督管理中最主要、最重要的法规,其他配套管理法规也逐步发布并实施,国家局、各省市也纷纷出台相关监管政策来规范第一类医疗器械产品的生产。作为第一类医疗器械生产企业较为集中的杭州市,本文阐述在新法规下杭州市关于第一类医疗器械的备案和监管现状,分析当下第一类医疗器械备案存在的一些误区和疑惑,并指出了第一类医疗器械备案过程中存在的共性问题。
![]()
医疗器械
医疗器械是指直接或间接作用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要是通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用[1]。如日常生活中所常见的骨科需要用到的踝部固定器(见图一)是通过力学原理,医院中用到的大型诊断设备CT机(见图二)是通过电磁原理,从而达到预期的作用目的。

第一类医疗器械的分类和特点
医疗器械按照风险程度划分为第一类、第二类、第三类医疗器械(见表一)。《条例》中也明确了医疗器械的风险应当根据产品的预期用途、结构特征、使用方法等因素来评定。这也决定了第一类医疗器械的特点是非无菌(培养基类产品除外)、非植入介入产品。
表1 医疗器械的按风险管理进行划分

![]()
根据目前市面上已经上市销售的第一类医疗器械笔者将其划分成5大类,分别是:
- 医用冷敷贴、液体敷料类
- 无源医疗器械类
- 有源医疗器械类
- 防辐射医疗器械类
- 体外诊断试剂类
具体这5大类产品特性的描述见图三。
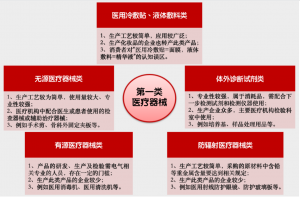
图三 第一类医疗器械的5大分类
![]()
杭州市第一类医疗器械的备案现状
根据浙江省药监局发布的数据显示[2],目前杭州现有第一类医疗器械生产企业505家,约占全省的1/3,企业多数集中于余杭区、临平区、萧山区和钱塘新区;近3年来,杭州第一类医疗器械的产品备案的业务量也激增,分别为1092件、1760件和2470件(见图四)。
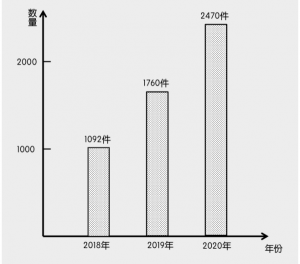
图四 2018-2020年杭州第一类医疗器械备案情况
在杭企业进行第一类医疗器械的备案所需条件
- 生产场地、人员资质的要求
医疗器械是比较特殊的产品,对生产场地和人员资质都有着其相对较高的要求,基本的第一类医疗器械生产场地应当由生产车间、原料仓库、成品仓库、检验室等功能区域组成,生产场地应干净、整洁、通风,各部分功能区域应不得相互干扰。人员资质的要求见表2。
表2 第一类医疗器械人员资质要求
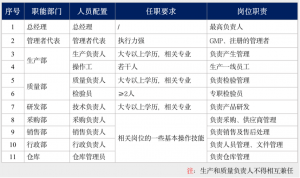
这里有一点值得注意,《医疗器械生产质量管理规范检查指南(第2册)》中规定第一类医疗器械的体外诊断试剂中的培养基类产品因其有无菌要求,需在10万级洁净车间环境下生产[3]。
- 备案产品组成成分的要求
第一类产品都是组成较为简单且不产生药理学、免疫学或者代谢的方式如水、甘油、聚乙烯等生活中常见的成分,但由于企业对产品的认知或是其他方面的原因对备案产品中的成分界定不清,特别是医用冷敷贴等这一类的产品,很多产品存在“低备高用”的情况。针对此类情况,国家药监局也发文对一部分第一类医疗器械的产品中的成分进行限制,明确了哪些不能添加的成分[4],具体禁止添加成分见表3。
表3 第一类医疗器械禁止添加成分名录
| 类别 | 具体成分 | 可能的归类 |
| 中药 | 芦荟、薄荷、蜂胶、蜂蜜、蜂蜡、冰片、没药、蓖麻子、乳香、威灵仙、辣椒、麝香、丁香、花椒、干姜、生姜、肉桂、细辛、白芷、滑石粉、姜黄 | 药品
保健食品 |
| 化学药物 | 硫酸软骨素、维生素、氨基酸、氧化锌、亚甲蓝、盐酸利多卡因 | 药品
保健食品 |
| 生物制品 | 血清白蛋白、细胞因子(如:重组人碱性成纤维细胞生长因子)、酶(凝血酶、胰蛋白酶、溶菌酶)、干扰素 | 药品 |
| 消毒、抗菌成分 | 含氯消毒剂、过氧化物类消毒剂、醛类消毒剂、醇类消毒剂、含碘消毒剂、酚类消毒剂、双肌类消毒剂、季铵盐类消毒剂、三唑酮、三氯生、盐酸奥替尼啶、葡萄糖酸氯己定、醋酸氯己定、羟苯甲酯钠、羟苯丙酯钠、苯扎氯铵、溴铵、银离子、锌离子、臭氧、二甲基亚砜、硫酸铜、碘伏、苯甲醇、二氧化氯、次氯酸、聚六亚甲基双胍、异丙醇 | 消毒产品
第二类、第三类医疗器械 |
| 天然植物及其提取物 | 洋甘菊、桉树叶、黄菊花、留兰香、爪钩草、山金车、绣线菊、西洋鼠尾草、七叶树、柳木、肉桂叶、柳珊瑚、百里香、仙人掌、茶树油、薰衣草、玫瑰 | 食品、保健食品
化妆品 |
| 其他 | 壳聚糖、单宁、二氧化钛、透明质酸钠、胶原蛋白、多肽、神经酰胺、角鲨烯 | 第二类、第三类医疗器械 |
注:禁止添加成分主要针对“06-08-01超声耦合剂” 、“09-02-03物理降温设备”、“09-03-08光治疗设备附件”、“14-10-02创口贴”“14-10-08液体、膏状敷料”目录下产品.
杭州市第一类医疗器械的监管
针对在杭企业进行第一类医疗器械备案存在的乱象和问题,杭州市市场监督管理局创新探索第一类医疗器械产品分级备案机制,进一步提升备案的审批质量和审批效率[2],具体分级备案机制见表4。
表4 杭州市第一类医疗器械分级机制
| 等级 | 备案要求 | 备案结果 |
| A | 主要包括产品名称、产品描述及预期用途与2017版医疗器械分类目录完全一致的,在国家药监局或国家药监局医疗器械标准管理中心发布的分类界定汇总或文件内的和由省药监局出具分类界定的。 | 直接办理,做到“一次性”即到即办,标准化审批。 |
| B | 主要为产品名称、产品描述、预期用途与分类目录有部分出入。 | 采用处室内部讨论形式,如仍无法得出明确结论则转为C级事项,提交联合会议讨论。 |
| C | 主要为从未碰到过的产品备案内容。 | 召集相关处室联合讨论,达成共识;如确实无法明确的,请示上级部门。 |
杭州市市场监督管理局医疗器械监管处周杰处长撰文指出,新《条例》的发布带来了以下四点新变化:一是实施备案人制度;二是实行告知性备案制度;三是明确委托生产制度;四是新增取消备案制度。可能带来的以下五点积极影响:一是有利于促进行业规范发展;二是进一步明确了备案人的主体责任;三是进一步强化了事中事后的监管要求;四是对事后监管提出了更高要求;五是进一步强化了对违法行为的惩处。将面临的新的问题:经营企业、使用单位如何履行主体责任,落实对第一类医疗器械的管理要求?第一类医疗器械界定需要更明确,可操作性更强,并加强指导。最后给出了建议:成立各级医疗器械产品界定委员会,提供技术意见和认定结论,解决企业和基层监管困惑,最终强化对上市后第一类医疗器械的安全监管,保障群众用械安全。
![]()
Q1:第一类医疗器械生产是否需要无菌车间/洁净车间/GMP车间?
除某类特殊医疗器械(培养基)外,大部分第一类医疗器械生产无需无菌车间/洁净车间,只需普通干净整洁的生产场地即可。
另:GMP车间不是正式的叫法,一般不采用。
Q2:第一类医疗器械生产是否可以委托生产/委托生产有什么要求?
第一类医疗器械可以按备案人制度委托生产,被委托的生产企业需要有类似产品的生产备案。
委托生产需要去省药品监督管理局备案。
Q3:第一类医疗器械备案企业是否需要GMP核查/委托生产需不需要GMP核查?
按《医疗器械监督管理条例》的要求,取得《第一类医疗器械生产备案凭证》后需要对备案人进行GMP现场核查,委托生产时需对被委托企业进行核查。
Q4:如果发现已备案第一类医疗器械含有表3中的禁止添加成分怎么办?
注销产品备案凭证,按对应的字号申请批文。
结语
国家药监局及各级药监局也意识到第一类医疗器械备案的问题所在,从新版《条例》和陆续出台的各项政策法规来看,加强了对第一类医疗器械的监管,违法行为将面临更高的罚款和处罚到人的要求,同时也加强了监督抽查的频率,其中杭州市药监局在监管第一类医疗器械方面丰富的经验也值得学习和借鉴。企业应该加强社会责任感,对于明确要求的“违禁”成分坚决不添加,准确传递产品信息,严格按照第一类医疗器械备案的要求进行申报,并在日常生产中抓好产品质量关。使用者也应擦亮自己的双眼,正确识别市面上各种第一类医疗器械产品的特点和用途,以免乱用或误用。
